
L'intelligenza artificiale è spesso associata a promesse futuristiche anche in campo medico, ma la vera sfida è capire dove può davvero fare la differenza e come. Al CNAO, il Centro Nazionale di Adroterapia Oncologica di Pavia, si trattano tumori inoperabili o resistenti alla radioterapia tradizionale utilizzando fasci di protoni e ioni carbonio con una precisione millimetrica. L'intelligenza artificiale non è ancora parte integrante di questi protocolli, ma si stanno studiando applicazioni molto concrete: migliorare la qualità delle immagini, ridurre i tempi delle sedute e ottimizzare il lavoro dei medici. Per capire dove siamo davvero e quali sono le prospettive future abbiamo invitato Andrea Pella, bioingegnere presso il CNAO.
Nella sezione delle notizie parliamo del nuovo ecosistema di Valve, che include Steam Machine e il visore Steam Frame e di Google che presenta Private AI Compute, la sua piattaforma cloud per l'esecuzione sicura di modelli di IA.


Immagini
• Figura copertina: Francesca Camagni in “Generation of multimodal realistic computational phantoms as a test-bed for validating deep learning-based cross-modality synthesis techniques”. Medical & biological engineering & computing
• Foto copertina: DC Studio su Freepik
Brani
• Ecstasy by Rabbit Theft
• No Pressure by Tim Beeren & xChenda
La scelta di CNAO è precisa: noi vogliamo certamente trattare il maggior numero di pazienti, ma al contempo offrire un trattamento con i più elevati standard.
Immaginare che l'intelligenza artificiale snellisca alcuni processi e alcune valutazioni è corretto.
Immaginare che l'intelligenza artificiale si sostituisca completamente e di conseguenza... immaginiamo un domani in cui tutto il reparto clinico sia incredibilmente più efficiente grazie a queste tecniche, no, dal mio punto di vista.
Salve a tutti, siete all'ascolto di INSiDER - Dentro la Tecnologia, un podcast di Digital People e io sono il vostro host, Davide Fasoli.
Oggi torneremo a parlare con il CNAO, il Centro Nazionale di Adroterapia Oncologica, di come l'intelligenza artificiale può migliorare concretamente i trattamenti dei pazienti, dalle immagini diagnostiche più precise alla riduzione dei tempi delle sedute.
Prima di passare alle notizie che più ci hanno colpito questa settimana, vi ricordo che potete seguirci su Instagram a @dentrolatecnologia, iscrivervi alla newsletter e ascoltare un nuovo episodio ogni sabato mattina, su Spotify, Apple Podcast, YouTube Music oppure direttamente sul nostro sito.
Qualche giorno fa Valve ha svelato il suo nuovo ecosistema hardware annunciando tre dispositivi destinati a rivoluzionare l'esperienza di gioco su PC, ovvero una nuova Steam Machine, un controller e soprattutto lo Steam Frame, un visore per la realtà virtuale.
Per quanto riguarda la Steam Machine stiamo parlando di un dispositivo con specifiche tecniche di tutto rispetto, tant'è che l'obiettivo di questo prodotto è offrire la potenza di un PC da gaming, ma in formato console, mantenendo la compatibilità con l'ecosistema Windows.
Il vero protagonista dell'annuncio è però lo Steam Frame, un visore ibrido che ambisce a superare i limiti della tecnologia della realtà virtuale.
Con un display da 2160x2160 pixel per occhio e refresh rate fino a 144Hz, il dispositivo offrirà un'esperienza visiva di altissimo livello.
Tuttavia la vera innovazione risiede nella sua duplice natura, può funzionare infatti collegato a un PC da gaming sfruttandone la potenza per esperienze grafiche avanzate, ma anche come dispositivo stand-alone grazie al processore Snapdragon 8 Gen 3 e 16GB di RAM.
Questa versatilità elimina finalmente la necessità di scegliere tra libertà di movimento e qualità grafica, aprendo possibilità inedite per gli sviluppatori e permettendo ai giocatori di accedere all'intera libreria di Steam in VR senza compromessi.
Il nuovo Steam Controller è infine pensato per completare la proposta, offrendo un dispositivo di input pensato per massimizzare la precisione e il comfort durante le sessioni di gioco.
Con i modelli di intelligenza artificiale che diventano via via sempre più avanzati e bisognosi di risorse computazionali, diventa impensabile che la tecnologia hardware riesca a stare al passo con queste necessità, soprattutto su prodotti come smartphone, tablet o dispositivi IoT.
Per questo motivo, Apple aveva introdotto il suo Private Cloud Compute, un luogo sicuro e privato dove poter eseguire i modelli di IA.
E Google ha da poco presentato un progetto simile chiamato Private AI Compute, una piattaforma cloud progettata proprio per rispondere alle necessità di accedere a un'enorme potenza computazionale senza però rinunciare alla privacy che può offrire l'esecuzione dei modelli in locale.
Private AI Compute si basa infatti su un ambiente di esecuzione protetto, dove tutti i componenti sono crittograficamente attestati e dove i dati sono isolati, criptati e di conseguenza inaccessibili né a Terzi né a Google stessa.
Anche il traffico stesso viene anonimizzato per evitare tracciamenti di dati che possono ricostruire le attività degli utenti.
Con questo progetto quindi Google vuole offrire - in special modo ai suoi utenti Pixel - funzionalità di IA sempre più avanzate, come Magic Cue o servizi di trascrizione delle registrazioni, indipendentemente dalla capacità hardware dei dispositivi e garantendo lo stesso livello di sicurezza e privacy dei modelli locali.
L'intelligenza artificiale è spesso associata a promesse futuristiche anche in campo medico, ma la vera sfida è capire dove e come può fare davvero la differenza.
Al CNAO, il Centro Nazionale di Adroterapia Oncologica di Pavia - come abbiamo scoperto in una puntata dello scorso anno - si trattano tumori inoperabili o resistenti alla radioterapia tradizionale utilizzando fasci di protoni e ioni carbonio con una precisione millimetrica.
L'intelligenza artificiale non è ancora parte integrante di questi protocolli, ma si stanno studiando applicazioni molto concrete, migliorare la qualità delle immagini, ridurre i tempi delle sedute, ottimizzare il lavoro dei medici.
Per capire lo stato di questa tecnologia, è con noi Andrea Pella, ingegnere presso il CNAO.
Benvenuto, Andrea.
Grazie mille Davide dell'invito, è un piacere sentirti, buongiorno.
Innanzitutto lo scorso anno, come dicevo, abbiamo realizzato già una puntata con voi, con Maria Monica Necchi, fisico, che ci ha raccontato un po' in generale che cos'è il CNAO, l'impatto che ha in ambito medico e quindi il ruolo della tecnologia all'interno del CNAO.
E dopodiché, nei mesi successivi, qualche mese fa, abbiamo avuto anche il piacere di venirvi a trovare e ci siamo resi conto che al CNAO lavorano tante figure diverse, oltre a medici.
Appunto c'è Maria Monica Necchi... e i suoi colleghi che sono fisici, ci siete voi che siete ingegneri.
Quindi, qual è il ruolo di tutte queste figure e come contribuiscono all'efficacia dei trattamenti sui pazienti?
È vero, a CNAO siamo in tanti e con background molto diversi, questo perché in qualsiasi moderno centro di radioterapia, ancora di più nei centri di adroterapia come CNAO, vengono utilizzati dei sistemi e degli strumenti molto complessi, di
conseguenza è per definizione un ambiente multidisciplinare, noi seguiamo durante i trattamenti e anche durante le fasi di ricerca protocolli molto precisi che riguardano l'ottimizzazione del piano di cura, garantire la ripetibilità e la sicurezza durante l'erogazione del trattamento.
Tutto questo viene fatto con strumenti all'avanguardia sia da un punto di vista software ma anche hardware con un approccio generalmente di tipo robotico e integrando tutti i vostri sistemi, per cui se ci riferiamo solo al dipartimento clinico si
trovano non solo i tecnici che si occupano di seguire durante le fasi il paziente, di aiutarlo durante il posizionamento giorno per giorno, ma anche il medico che arruola i pazienti, che seleziona la migliore strategia e supervisiona poi tutti i
processi fino al follow up, troviamo sicuramente il fisico medico che ottimizza il piano e quindi valuta la miglior geometria con cui andare a trattare le masse tumorali e troviamo anche i bioingegneri - di cui io faccio parte - e che collaborano
nello studio della fattibilità geometrica... noi siamo sostanzialmente figure ponte tra l'approccio robotico e l'approccio puramente clinico del medico e del fisico medico.
Sono competenze molto diverse, si integrano per contribuire all'efficacia del trattamento.
Io approfitto anche per ricordare che tutto questo è fattibile, come ricordavi tu prima, anche grazie al lavoro di fisico di macchina, fisico di particella, gli operatori e i manutentori e insomma tutte le altre figure che spero di non dimenticare.
Sì sì certo giustamente ho citato solo una parte, però effettivamente poi le persone che collaborano che lavorano per arrivare poi al trattamento finale del singolo paziente sono tantissime ed è molto affascinante ecco tutto questo.
Quindi ci racconti anche in cosa consiste nello specifico il tuo lavoro?
Quindi cosa fa un ingegnere... raccontaci un po' quello che fai quotidianamente.
C'è tutta una parte di supporto all'attività clinica, come anticipavo prima, che riguarda accompagnare nella definizione di nuove strategie o nuovi protocolli per il trattamento di tumori complessi.
Nei miei studi io sono principalmente legato al caso di lesioni mobili, quindi quando un movimento fisiologico come il respiro, ad esempio, fa in qualche modo muovere anche la massa tumorale, in un trattamento molto preciso come quello con le
particelle accelerate può essere un aspetto critico, perché noi cerchiamo sempre di inseguire un'accuratezza submillimetrica, chiaramente se siamo di fronte a una dinamica della lesione tumorale fino anche a qualche centimetro - nel caso delle lesioni polmonari - questi aspetti vanno investigati e minimizzati.
Mi occupo anche degli aspetti di manutenzione, di tutti i sistemi dedicati a CNAO, CNAO è sostanzialmente un centro unico al mondo in cui molti strumenti, molte macchine, anche molti software sono stati costruiti attorno al caso CNAO e di
conseguenza sono unici al mondo e come tali vanno mantenuti e misurati in termini banalmente anche del loro funzionamento e corretto funzionamento e poi mi occupo di ricerca e sviluppo, ricerca e sviluppo chiaramente da bioingegnere è legato al
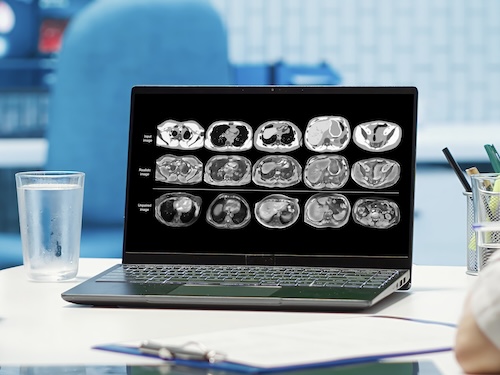
dipartimento clinico, quindi si spazia dallo studio di nuovi dispositivi stampati con materiali innovativi in 3D per ottimizzare il setup e l'immobilizzazione del paziente fino all'elaborazione di immagini per offrire in modo più consistente la maggiore informazione possibile per una valutazione clinica.
Questo si fa utilizzando sia le immagini diagnostiche ovvero quelle acquisite durante le fasi di simulazione di un trattamento e che vengono registrate dalle TAC oppure dalle risonanze magnetiche fino anche all'imaging vero e proprio in sala di
trattamento, ovvero quello che noi utilizziamo per verificare la consistenza di come noi abbiamo preparato il paziente alla sua seduta giornaliera con quanto pianificato.
Ok quindi hai parlato anche di ricerca e sviluppo, quindi di fatto si tratta di guardare al futuro e di vedere come si può migliorare o ottimizzare il lavoro di trattamento ecco... migliorare i trattamenti, parlavi di diagnostica per immagini ci racconti questo aspetto?
Quindi oggi parliamo tanto come dicevo nell'introduzione di intelligenza artificiale, voi come la state studiando per utilizzarla in futuro l'intelligenza artificiale, all'interno del CNAO, al fine appunto di migliorare l'interpretazione da parte del medico della diagnostica per immagini e farci che il trattamento sia sempre più mirato?
Uno dei miei obiettivi più forti è sicuramente quello di essere in grado di offrire al clinico il maggior numero di informazioni possibili per poter prendere delle decisioni in modo consapevole.
Questo passa attraverso anche una valutazione di immagini, perché se noi volessimo in qualche modo raccontare la radioterapia e la radioterapia con particelle in piccole pillole, questo prevede una prima fase di simulazione, in cui vengono acquisite
delle immagini standard sono, ad esempio, la risonanza magnetica o la scansione TAC, della sede, della porzione del paziente che dovrà essere trattata.
Queste devono necessariamente essere ad alta risoluzione perché su queste immagini viene ottimizzato il piano di cura.
E ricordo qui è un paziente specifico ed è una fotografia, in qualche modo statica, dell'anatomia del paziente di quel giorno.
E poi per necessità noi suddividiamo la dose e la terapia in più giorni consecutivi o meno e questo vuol dire che di volta in volta il paziente torna a CNAO e prima di ricevere la sua porzione, la sua frazione di dose quotidiana, noi dobbiamo
essere certi e assicurarci che sia posizionato nel miglior modo possibile in modo uguale a quando è stato preparato e ottimizzato il piano di cura.
E come si fa?
Con un secondo set di immagini, chiaramente l'obiettivo in questo secondo set di immagini non è un'ottimizzazione spinta di numero di particelle o di iterazione del fascio radiante con i tessuti, ma è semplicemente quello di validare la posizione del paziente pochi istanti prima di rilasciare la dose di cura.
E quindi sono intrinsecamente degli strumenti che utilizzano una quantità di energia e di radiazioni più bassa e questo è un bene per il paziente che riceve meno dose, non a fini diagnostici o di cura, ma assolutamente necessaria per riallinearci a quanto desiderato.
Quello che noi chiamiamo sostanzialmente la posizione nominale di cura.
Queste immagini, come anticipato, sono meno raffinate da un certo punto di vista, ma al loro interno contengono tutte le informazioni che riguardano il paziente e la sua situazione anatomica in quell'istante.
Parte del mio lavoro, di conseguenza, è quello di cercare di estrarre più informazione possibile da queste immagini a una risoluzione più bassa di un'imaging diagnostico classico, in modo da rendere più confrontabili quanto fatto in simulazione e quanto si vede di giorno in giorno.
Non è assolutamente inusuale questo tipo di approccio perché chiaramente un paziente di giorno in giorno presenta delle piccole variazioni, basti pensare che magari si posiziona sul lettino, sulla sedia di trattamento in modo leggermente diverso,
magari vi sono presenze nelle pelvi di piccole sacche d'aria che sono assolutamente fisiologiche, piuttosto che il grado o meno di riempimento di una vescica.
Ecco, in un trattamento a un'alta selettività geometrica come quello con particelle accelerate, questi scostamenti devono essere quantificati ed eventualmente corretti.
L'utilizzo delle immagini che sono state acquisite nelle sale di trattamento e portarle a livello di un'imaging diagnostico è sicuramente un campo in cui gli approcci di deep learning, approcci con metodi che ad oggi chiamiamo... riferiamo a questi,
con intelligenza artificiale, è sicuramente un vantaggio ed è una nuova frontiera della ricerca che ha anche dei risvolti molto interessanti.
Ok e questo approccio che sfide rappresenta cioè... come faccio da un'immagine da una diagnostica per immagini a risoluzione più bassa a determinare appunto... aumentarne la qualità ecco?
In qualche modo cercando degli strumenti che siano in grado di apprendere l'anatomia del paziente e di conseguenza andando a riconoscere delle strutture, come possono essere ad esempio l'anatomia ossea piuttosto che un polmone o quant'altro, andando
a stimare e ricostruire un'immagine che sia più dettagliata, più contrastata e con una profondità nei grigi, nella qualità dell'immagine che sia più ricca.
Tutti o quasi i metodi che si appoggiano sull'intelligenza artificiale partono da un processo di addestramento e in questo caso specifico l'addestramento vede come migliore effetto, migliore outcome, miglior risultato possibile, la mia TAC diagnostica, vede come immagine da processare l'imaging acquisito in sala.
Quindi, come dicevamo, un'imaging con una risoluzione ridotta e tendenzialmente anche con dei volumi ricostruiti più piccoli se confrontati con quelli di una TAC standard.
Ok, ma come si fa ad addestrare - in questo senso - un sistema di questo tipo?
Cioè servono dati raccolti di altri pazienti di immagini a più alta risoluzione per determinare appunto questi elementi che hai detto sono riconoscibili.
Esatto, è necessario collezionare un numero adeguato di esempi da mostrare al modello, di conseguenza si parte con una relazione tra una serie di dati che noi abbiamo registrato durante i nostri trattamenti in modo assolutamente trasparente perché
rientrano nella pratica clinica per poter erogare in sicurezza la seduta e lo si fa mettendoli in relazione alla TAC di pianificazione di quel trattamento.
Qual è l'obiettivo?
È quello di costruire un sistema che sia in grado di generalizzare abbastanza e di fronte a dei nuovi pazienti, di fronte a un nuovo imaging, si faccia in qualche modo vantaggio di un addestramento su un numero elevato di casi per produrre un risultato adeguato.
La sfida più grossa è quella di riuscire a scegliere, combinare e raccogliere appunto questo numero adeguato di casi, perché su questo io sono stato un po' generale, però chiaramente sono metodi che idealmente vogliono un altissimo numero di
esempi per essere poi trasferiti in un'applicazione robusta e sicura in una pratica clinica, perché di fondo è sempre vero che l'intelligenza artificiale da una parte è energivora, quindi ha necessità di tempo macchina, ha necessità di risorse,
ha necessità di tempo per essere in qualche modo addestrata adeguatamente e dall'altra richiede un numero di esempi, un numero di casi molto molto alto e questo è un collo di bottiglia molto spesso perché coprire la vastità e mirare a un metodo
che sia così tanto generalista prevede idealmente che almeno diverse volte quel tipo di caso clinico, quel tipo di situazione anatomico-fisiologica sia stata vista e digerita dal metodo matematico.
Questa seconda parte è sicuramente un aspetto critico quando si lavora con l'intelligenza artificiale.
Non ultimo, una forte dipendenza si ha anche da il tipo di strumenti con cui le immagini vengono raccolte e di conseguenza non si può pensare che qualsiasi TAC, qualsiasi Cone beam CT al mondo possano essere racchiusi in un unico contenitore.
Che questi due aspetti che ci trovo adesso sono quello della "quantità" e della "qualità" quindi cioè da una parte... e questo mi ricordo che ce lo dicevi anche quando siamo venuti a trovarvi cioè che il problema, come dicevi, il collo di
bottiglia è il fatto che benché comunque trattiate tanti pazienti però sono pochissimi rispetto a quello che serve per addestrare un modello di questo tipo e poi dall'altra parte la qualità, quindi anche su quell' aspetto non tutti i dati possono essere utilizzati.
Questo come mai?
Perché alcuni presentano delle caratteristiche uniche, ed è la parte molto stimolante...
Quindi vanno scartati.
In genere si scartano, ma... di nuovo, sono delle particolarità non così remote in un ambito clinico.
Pensiamo ad esempio alla presenza di una protesi d'anca, quella è una variazione, una singolarità molto forte, per cui generalizzare la presenza di una protesi d'anca, oppure sperare che un metodo addestrato facendo solo vedere anche naturali, si
comporti bene in presenza di un artefatto da metallo, quindi da un disturbo del segnale che è assolutamente gestibile lato interfaccia con il clinico, ma non lato ottimizzazione di un metodo su intelligenza artificiale, ecco questo è un buon esempio.
La qualità delle immagini è assolutamente un punto cardine, come anche l'eterogeneità del dato, ovvero deve essere molto rappresentativo di quello che io poi vado a investigare o studiare, sono casi più o meno complessi, un caso più semplice
può essere il riconoscimento di un polmone che ha una differenza sostanziale nella densità rispetto ai volumi che lo circondano, un caso relativamente semplice può essere una lesione a livello dell'ecefalo, casi più complessi sono quelli che riguardano il distretto pelvico in cui la variabilità è molto più forte.
Quindi il riempimento, lo svuotamento di organi critici come un retto o una vescica, piuttosto che anche la mobilità dei tessuti molli sono assolutamente aspetti da considerare.
Sì quindi l'efficacia di un sistema di questo tipo dipende anche molto dalla parte del corpo che si sta considerando.
Sì, cambia appunto in questi termini, cambia perché in qualche modo la variabilità del sistema che si sta studiando è più alta, di conseguenza anche la complessità dell'architettura del metodo che viene studiato ne deve tener di conto e qui
c'è un po' il gioco delle due parti: più alzo la complessità di un metodo basato su intelligenza artificiale, idealmente ho molto più bisogno di dati robusti, uniformati o meno, da poter dare impasto per avere una stima concreta e corretta.
E ad oggi quali sono i risultati che avete ottenuto?
Ovviamente non sono clinicamente approvati e non li utilizzate nella realtà, però che cosa siete riusciti ad ottenere ad oggi?
È bene sottolinearlo - come hai fatto tu - che in questo ambito quello che stiamo raccontando fa parte del mondo della ricerca e di conseguenza non ha né un utilizzo né un impatto clinico oggi.
Nel futuro prevedo che queste cose e questa affermazione andranno a cambiare, però oggi si sta parlando solo di sviluppo e di ricerca.
Abbiamo deciso per andare nel concreto a CNAO di fare uno studio a due livelli, il primo livello è quello di utilizzare i nostri dati per andare a migliorare la qualità dell'immagine acquisita al tempo del trattamento, quindi quella che serve per posizionare il paziente e assicurarci che stiamo replicando la posizione nominale.
E questo, sostanzialmente, ha solo un impatto qualitativo.
Noi utilizziamo quelle immagini, le in qualche modo filtriamo all'interno dell'intelligenza artificiale per andare a migliorare la qualità del contrasto dell'immagine, le linee di contorni di organi sensibili e ovviamente anche la profondità nella
scala di grigi con cui viene valutata l'immagine e senza sostanzialmente modificare l'anatomia di quello che andiamo a vedere.
Perché lo si fa?
Perché stiamo cercando, come dicevo, di offrire al clinico che valuta queste immagini l'esperienza migliore.
E un'esperienza migliore per il clinico corrisponde anche a una più immediata risposta in una direzione di validazione della posizione piuttosto che di necessità di riposizionare il paziente o di applicare ulteriori correzioni a quanto vede.
Questa prima fase ha sostanzialmente un impatto quotidiano molto positivo e ripeto è assolutamente qualitativa, quindi stiamo raccogliendo il feedback da parte dei medici che ci danno delle indicazioni perché anche la scelta di che cosa mettere in
evidenza all'interno di un'immagine di una pelvi è oggetto di studio, quindi se per caso una lesione è in prossimità del sacro o delle ossa della spina, rispetto a una lesione molto superficiale sulla cute piuttosto che una lesione a una
prostata, prevede anche un trattamento leggermente diverso dei parametri che noi andiamo a utilizzare.
Il secondo step è molto più ambizioso perché riguarda la possibilità di raggiungere un'elevata qualità di uscita dei nostri processi con l'intelligenza artificiale e di andare a generare del set, delle TAC sintetiche, quindi delle TAC che il
paziente in realtà non ha mai acquisito ma che noi ricostruiamo utilizzando le informazioni giornaliere del paziente per fini completamente diversi, come possono essere ad esempio un ricalcolo dei piani sull'anatomia giornaliera piuttosto che per
fare altri studi comparativi con diversi approcci, quindi sono questi due livelli per quanto riguarda l'utilizzo delle immagini, il primo è mira migliorare la qualità dell'immagine per una valutazione clinica, ma non cambia nulla da un punto di
vista di protocollo o di approccio generale all'esperienza del paziente, il secondo poter offrire un ulteriore strumento per valutazioni anche dosimetriche in futuro.
Ok e questi i risultati l'output avviene in tempo reale?
Cioè il medico può vedere questo output subito dopo aver fatto la scansione ecco.
Mentre parliamo questa cosa avviene offline, quindi noi non tocchiamo in alcun modo il processo e il workflow clinico, collezioniamo queste immagini, le rielaboriamo e come dicevo stiamo raccogliendo esatto dei feedback anche che possono essere utili
per scegliere banalmente la profondità dell'architettura di queste reti e altri parametri più tecnici.
In realtà la ricostruzione di un'immagine è abbastanza veloce, si parla di... ad oggi un tempo relativamente compatibile con un'attività clinica, quindi dipende sempre dall'ampiezza del campo di vista e dipende anche da qual è la finalità, se è
una ricostruzione di un intero set sintetico oppure un processo in qualche modo di filtraggio da intelligenza artificiale, queste due cose sono molto diverse, diciamo che il primo approccio è molto veloce, nel secondo caso quello di avere un completo set sintetico richiede ad oggi qualche minuto.
Ok e poi un'altra questione che si pone spesso quando si parla di intelligenza artificiale e questo forse è il caso... uno dei più importanti a cui chiedo questa domanda è proprio quello delle allucinazioni perché... cioè se c'è una
allucinazione quindi l'intelligenza artificiale sbaglia a interpretare l'immagine è un problema evidentemente e come si può evitare questa cosa avete già pensato a questo aspetto?
Sì, è corretto, perché nei casi di falsi positivi o falsi negativi, nella ricostruzione di alcuni...
Anche perché scusa stiamo parlando - ricordiamolo sempre - di un intervento estremamente preciso.
È ancora maggiore questo rischio perché sbagliare anche di pochissimo inficia sul risultato del trattamento, l'efficacia.
Sì e non solo per la caratteristica delle particelle e del nostro tipo di trattamento, la variazione anche nell'interfaccia tra diversi tessuti ricostruita in modo sbagliato può portare a una stima di deposizione di dose all'interno del tumore completamente, o comunque diversa in modo significativo.
È sicuramente un punto chiave e credo anche che sia il principale motivo per cui questi strumenti ad oggi siano all'interno della ricerca più che nella pratica clinica.
Io immagino anche qui due livelli completamente diversi.
Il primo è quello di dare un supporto all'attività clinica, di conseguenza io so per certo che la validazione e anche la valutazione di quanto viene rappresentato a schermo passerà a un occhio clinico e a un occhio esperto e questo abiliterà o meno il trattamento in base a quanto in qualche modo siamo riusciti a ricostruire.
Se invece si sta trattando di guida autonoma - se mi permetti questo salto un pochino - ovvero immaginare un approccio "totale" dell'intelligenza artificiale nella gestione di un setup e di un workflow clinico, questo non è ancora disponibile, anche
perché il rischio di andare a generare degli artefatti più che minimizzarli è considerevole e va evitato, non limitato, va assolutamente evitato.
In questo punto di vista è importante anche l'iterazione di nuovo tra le diverse figure che lavorano attorno al paziente, sicuramente bisogna scindere molto bene quello che può essere un aiuto e un supporto nell'attività clinica e quindi
migliorare la qualità di un'immagine senza stravolgerne morfologia, senza stravolgere l'anatomia del paziente, è molto diverso da offrire uno strumento stand alone che sia in grado di rigenerare delle serie di immagini medicali su un paziente, questo oggi non avviene.
E pensavo poi a un'altra cosa, tornando al discorso appunto in generale della ricerca e lo sviluppo in ambito di intelligenza artificiale, cioè adesso abbiamo parlato tanto di rendere più efficiente il trattamento questo può significare anche che
il CNAO può trattare più pazienti in questo senso cioè l'intelligenza artificiale può velocizzare il trattamento e quindi portare di fatto a generare più possibilità di trattamenti?
La scelta di CNAO è precisa, noi vogliamo certamente trattare il maggior numero di pazienti ma al contempo offrire un trattamento con i più elevati standard sia in termini di qualità che di ottimizzazione e ogni trattamento viene studiato sul singolo caso del singolo paziente.
Immaginare che l'intelligenza artificiale snellisca alcuni processi e alcune valutazioni è corretto.
Immaginare che l'intelligenza artificiale si sostituisca completamente e di conseguenza immaginiamo un domani in cui tutto il reparto clinico sia incredibilmente più efficiente grazie a queste tecniche, no, dal mio punto di vista, perché è sempre necessario considerare la singolarità.
Per quello che dicevi prima, è fondamentale l'intervento umano, la scelta di un occhio esperto che valuti la situazione nel concreto.
Sì, è più semplice valutare due immagini ad alta risoluzione?
Probabilmente per alcune cose sì, però noi non stravolgiamo l'informazione a disposizione, semplicemente la manipoliamo perché sia più visibile durante le fasi di validazione del trattamento, è un po' come se in questo caso specifico di cui
stiamo parlando noi frapponessimo una lente, noi tutti siamo in grado di leggere bene però magari con una lente adeguata sono in grado di distinguere anche dei dettagli in più e per cui mi è in qualche modo più semplice procedere verso una
valutazione, però sulla numerosità dei pazienti piuttosto che su un cambio generazionale da un punto di vista di efficienza no, perché riguarda non solo il paziente ma anche la capacità della macchina di erogare il fascio, la differenziazione anche di come noi estraiamo il fascio e che a sua volta dipende dal singolo caso clinico.
Quindi la vedo come una incredibile opportunità in cui non c'è nulla da perdere perché andiamo a migliorare l'esperienza di chi valuta e anche ovviamente di chi è valutato, ma non in termini puramente di numerosità.
Perfetto e per chiudere abbiamo citato questi due esempi ecco... ci hai raccontato questi due esempi dell'utilizzo dell'intelligenza artificiale, sono gli unici o ce ne sono anche altri.
Ce n'è un altro su cui stiamo lavorando e ci stiamo concentrando molto in questo momento ed è completamente diverso perché non riguarda l'utilizzo di Cone beam CT o immagini radiografiche acquisite, diciamo, pochi istanti prima del trattamento, ma
riguarda la ricostruzione automatica di punti di riferimento sulle superfici e in questo caso particolare, noi la utilizziamo per i trattamenti del melanoma oculare, quindi durante il trattamento del melanoma oculare è un trattamento molto
particolare, molto diverso rispetto agli altri e in cui al paziente che collabora attivamente in tutte le fasi viene chiesto di guardare una lucina che noi posizioniamo all'interno della stanza e di mantenere lo sguardo fisso verso questa lucina,
questo viene fatto per esporre alla linea del fascio di cura la massa tumorale, cercando di minimizzare il più possibile l'esposizione di cristallino, della ghiandola lacrimare, del nervo ottico e insomma di tutti quei organi a rischio che sono in prossimità del tumore.
E' chiaro che noi confidiamo nella piena collaborazione del paziente, ma abbiamo anche necessità di avere strumenti che permettano un'immediata interruzione del fascio se il paziente si distrae o se si stanca oppure se non raggiunge esattamente la posizione di riferimento che noi abbiamo studiato.
Come si fa?
Nel nostro caso anche qui si acquisiscono delle immagini di piccoli riferimenti metallici sotturati sul rettore dell'occhio ma in modo in real time, quindi costantemente durante tutte le fasi, andiamo a utilizzare delle telecamere con cui guardiamo
la superficie del bulbo oculare e su queste, una volta che il paziente sta guardando verso il riferimento, siamo in grado di andare a tracciare a mano dei contorni di iride e di pupilla che vengono utilizzati in modo molto più rapido per permettere o bloccare il fascio radiante.
Bene, questa procedura di segmentazione manuale di iride e pupilla è un esempio perfetto di possibile utilizzo di intelligenza artificiale che in questo caso è usata per il riconoscimento semantico, comunque sia, dei profili, di queste strutture di
interesse, lo riesce a produrre molto velocemente, quindi anche per rispondere alla domanda di prima, questo è uno dei casi in cui noi siamo in grado di seguire in tempo reale il diverso orientamento dell'occhio e poter anche in questo caso offrire
da una parte una possibile soluzione che il clinico valida oppure no in base al proprio gusto e alla propria esperienza e il secondo luogo irrobustire anche il possibile segnale di sicurezza di interruzione fascio se viene monitorato uno scostamento rispetto a quanto a quanto diciamo immaginato.
E' molto utile anche per la costruzione di modelli di bulbo oculare, per cui anche in questo caso le potenzialità sono tante.
Va bene, tutto veramente interessante, grazie di averci raccontato degli esempi pratici, come dicevo prima, di come può essere utilizzata l'intelligenza artificiale e poi soprattutto molto originali perché avete delle esigenze specifiche che sono
proprio solo vostre, ecco, è quindi c'è sicuramente molto lavoro dietro nello sviluppare sistemi di questo tipo.
Quindi, grazie Andrea e alla prossima.
Grazie mille Davide, a te e a chi ascolta, grazie mille.
E così si conclude questa puntata di INSiDER - Dentro la Tecnologia, io ringrazio come sempre la redazione e in special modo Matteo Gallo e Luca Martinelli che ogni sabato mattina ci permettono di pubblicare un nuovo episodio.
Per qualsiasi tipo di domanda o suggerimento scriveteci a redazione@dentrolatecnologia.it, seguiteci su Instagram a @dentrolatecnologia dove durante la settimana pubblichiamo notizie e approfondimenti.
In qualsiasi caso nella descrizione della puntata troverete tutti i nostri social.
Se trovate interessante il podcast condividetelo che per noi è un ottimo modo per crescere e non dimenticate di farci pubblicità.
Noi ci sentiamo la settimana prossima.





